利用数据库数据进行定制化的生信分析
让您的文字更出彩
|
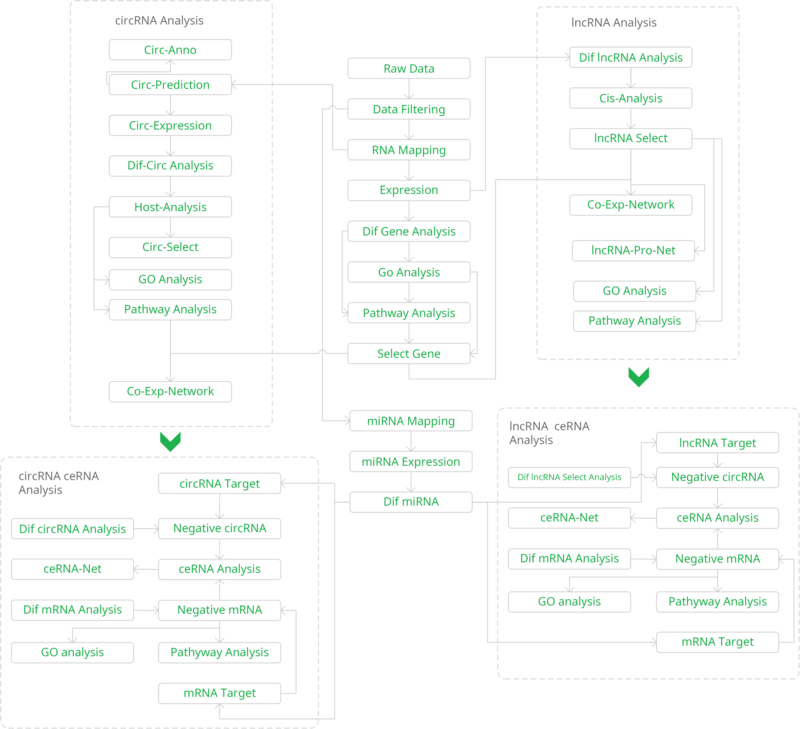
全转录组测序全转录组是指特定细胞在特定状态下所能转录出来的所有RNA的总和,包括mRNA和非编码RNA(non-coding RNA)。针对非编码RNA的研究主要集中在具有调控作用的miRNA,lncRNA和circRNA。基于二代测序技术的全转录组测序研究,同时分析同一样本中的mRNA,lncRNA,circRNA,miRNA,并且通过两两关联分析、三元关联分析、多元关联分析,使研究内容更加系统化,致力于深入挖掘生命现象背后的转录调控问题。
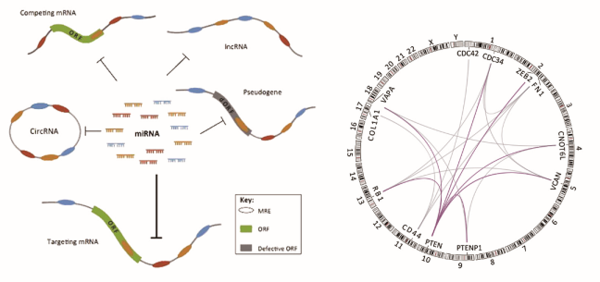
ceRNA(竞争性内源RNA)机制示意图 Wang Y et al., Trends Genet, 2016 我们的优势1. 双文库构建:small RNA文库和去核糖体的链特异性文库,8年建库经验,保证建库质量; 2. 4种RNA全方位分析:不仅能定量分析已知的lncRNA和miRNA,还能通过Stringtie重建转录本预测新的lncRNA;并通过预测的circRNA进行靶向分析 ,从而得到miRNA-mRNA、lncRNA-miRNA、以及circRNA-miRNA的靶向关系; 3. 数据库全面整合:整合并定时升级生物学领域内公认数据库和靶基因预测算法,如NP Inter、miRBase、RNAhybrid等,保证分析结果紧跟行业前沿; 4. 上游测序+下游验证:客户只需提供细胞,组织或者总RNA,为您完成从上机测序到数据分析整套服务流程,同时可进行后续qPCR验证。 样本要求组织样品: 1. 动物组织≥1g; 2. 植物组织≥2g; 3. 细胞样品≥1×106个; 4. 全血≥5mL; 5. 菌体≥106个或≥30mg。 RNA样品: 1. 样品需求量: RNA≥10 μg; 2. 样品浓度:RNA样品≥100 ng/μl; 3. 样品纯度:OD260/OD280在1.8-2.2之间,OD260/OD230≥2,28S/18S≥1,动物样品RIN≥7.0,植物样品RIN≥6.5,RNA无明显降解。 实验流程
1. 客户样本:细胞量在106以上; 2. 总RNA提取及质控:凝胶电泳质控→Nanodrop质控→Agilent 2200质控; 3. small RNA文库构建:切胶范围10-50bp,单端测序SE50,文库分子18-30bp; 4. 去核糖体文库构建:逆转录后用RNase处理,去除rRNA; 5. 上机测序:建议选择NovaSeq,双端测序,通量大,碱基精度高,而且成本低,速度快。 数据分析流程
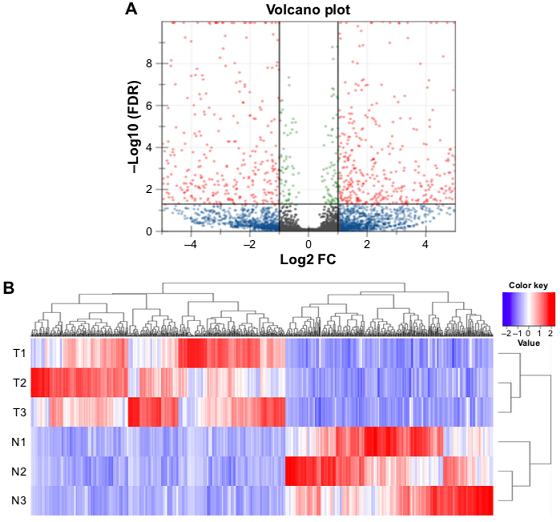
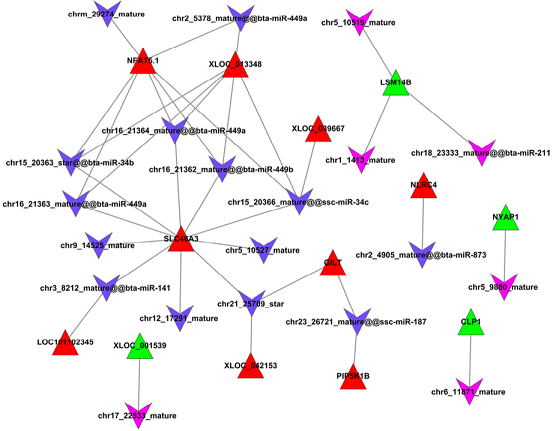
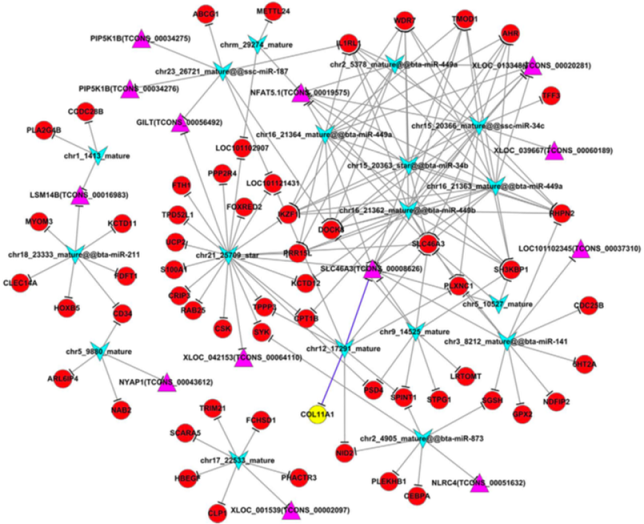
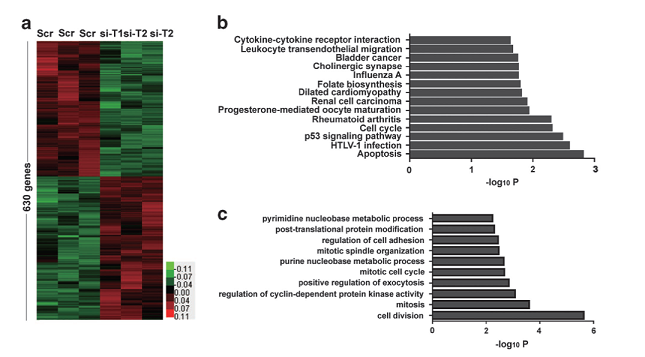
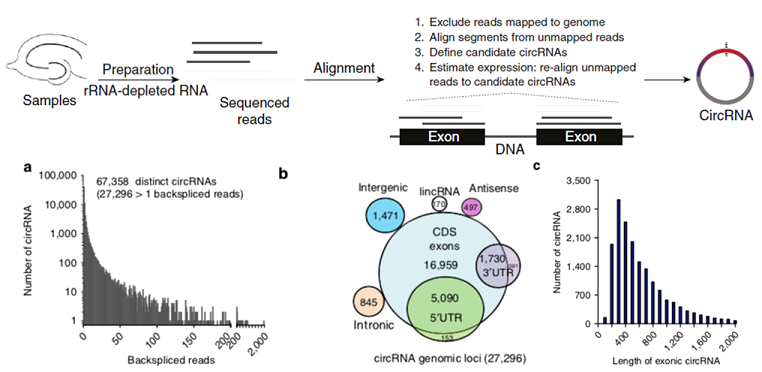
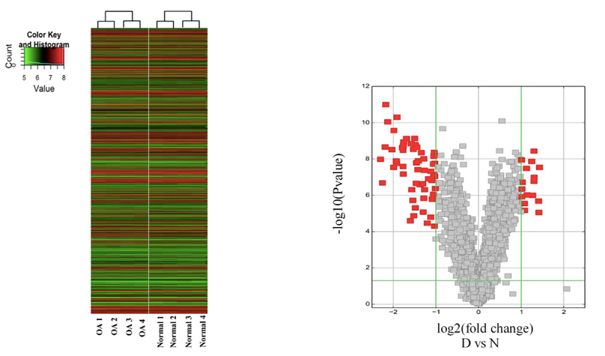
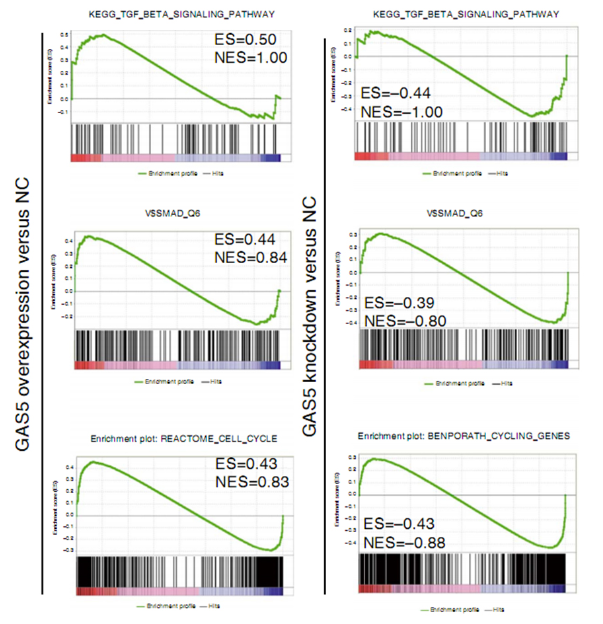
结果示例1、mRNA数据分析结果展示详见“转录组测序” 2、miRNA数据分析结果展示详见“small RNA测序” 3、LncRNA鉴定和差异lncRNA分析以RNA mapping得到的counts为研究对象,采用NCBI Gene/Ensembl Biomart/NONCODE等数据库的Genetype注释信息,对已知的lncRNA/假基因/其它长链非编码RNA进行鉴定。随后,以这些lncRNAs 的counts为研究对象,采用DESeq2/DESeq/EBSeq/EdgeR/Limma等算法进行差异筛选,得到满足差异倍数以及FDR阈值的差异基因(Dif-lncRNA)。并基于差异筛选结果,进行火山图以及聚类分析,得到Volcano Plot和Cluster Heatmap。 差异lncRNAs火山图分析和聚类分析 Yang F et al., Gene, 2016 注:(A)差异lncRNA火山图分析结果,红色表示显著差异的lncRNA,蓝色表示非显著差异的lncRNA;(B)差异lncRNA聚类分析的Heat map,红色越深表示lncRNA上调越显著,蓝色越深表示lncRNA下调越显著。 4、lncRNA靶向分析以差异lncRNAs、差异miRNAs为研究对象,采用miRanda算法和RNAhybrid算法进行靶基因预测,得到lncRNA-miRNA靶向作用关系。 lncRNA-miRNA靶向作用关系 Miao X et al., Sci Rep, 2016 注:红色三角表示上调lncRNAs,绿色三角表示下调lncRNAs,紫色V型三角表示上调miRNAs,蓝色V型三角表示下调miRNAs。 5、ceRNA分析以lncRNA-miRNA靶向关系为研究对象,再联合miRNA靶向基因的信息,采用负相关分析方法,得到lncRNA-miRNA-mRNA的ceRNA关系,并绘制lncRNA-miRNA-mRNA Network。 lncRNA-miRNA-mRNA Network Miao X et al., Sci Rep, 2016 注:紫色三角形表示lncRNA,红色圆点表示mRNA,黄色圆点表示关键mRNA,蓝色V型三角表示miRNA。 6、ceRNA基因功能分析(GO Analysis)和信号通路分析(Pathway Analysis)以ceRNA为研究对象,分别采用NCBI/UNIPROT/SWISSPROT/AMIGO等GO数据库,以及KEGG数据库,对差异基因进行功能分析和信号通路分析,从而得到ceRNA基因所显著富集的功能条目和pathway条目。 差异基因GO分析和Pathway分析 Xu T et al., Oncogene. 2015 注:(a)lncRNA TINCR-siRNA VS scrambled siRNA差异基因聚类分析图;(b)差异基因显著富集的pathway条目;(c)差异基因显著富集的GO条目。 7、circRNA预测环状RNA(circRNA)是区别于传统线性RNA的一类新型RNA,具有闭合环状结构。我们根据circRNA在表达过程中的特殊剪接形式,采用circexplorer/CIRI/ACFS/find_circ等算法,对测序得到的reads进行circRNA预测,可以发现同时覆盖两个外显子且方向与线性RNA相反的circRNA,以及一些Intergenic或者Intron区域来源的新的circRNA。 circRNA预测工作流和预测结果(正常组织 VS 癌组织) Chen W et al., Nat Neurosci. 2015/Zheng Q et al., Nature Communications, 2016 注:(a)横坐标表示circRNA反向剪接reads数,纵坐标表示circRNA数量;(b)circRNA在基因组结构上的分布;(c)横坐标表示exonic circRNA长度,纵坐标表示circRNA数量。 8、差异circRNA分析以预测的circRNA为研究对象,采用DESeq2/DESeq/EBSeq/EdgeR/Limma等算法进行差异筛选,得到满足差异倍数(Log2FC>1或<-1)以及FDR阈值(FDR<0.05)的差异circRNA(Dif-circRNA)。 差异circRNA分析结果 Liu Q et al., Scientific Reports, 2016 注:左图为差异circRNA的聚类分析图(OA VS normal软骨组织);右图为差异circRNA的火山图,红点表示差异显著的circRNA。 9、circRNA靶向分析以差异circRNA为研究对象,采用miranda算法与RNAHybrid算法进行靶向调控关系预测,得到miRNA与差异circRNA靶向调控关系。 circRNA-miRNA相互作用 Zheng Q et al., Nature Communications, 2016 注:该图展示了circHIPK3相互作用的miRNAs的假定结合位点。 10、ceRNA分析以circRNA-miRNA靶向关系为研究对象,再联合miRNA靶向基因的信息,采用负相关分析方法,得到circRNA-miRNA-mRNA的ceRNA关系,并绘制circRNA-miRNA-mRNA Network。 circRNA-miRNA-mRNA Network Liu Q et al., Scientific Reports, 2016 注:绿色圆点表示circRNA,黄色菱形表示mRNA,紫色V型三角表示miRNA。 11、WGCNA功能预测加权基因共表达网络(Weighted Gene Co-expression Network Analysis,WGCNA)是一个基于基因表达数据,构建基因共表达网络的方法。NovelBio团队协助研究者利用WGCNA进行功能预测,根据基因表达模式,将基因进行分组。根据“凡是能够互相形成共表达关系并且成簇的基因,具有类似的功能”,可以认为circRNA和它所属簇中mRNA具有类似的功能,并且可以通过mRNA所富集功能和信号通路对circRNA对于表型的影响进行预测。 circRNA和蛋白编码基因的WGCNA分析 Wang Z et al. Frontiers in plant science, 2017 注:该图为WGCNA计算出来的不同module,与不同表型相关性高的module,并对moudle16以及两个circRNA的关系网络图分别进行了可视化展示。 1、 韦恩分析(Venn Analysis)以实验中需解决的科学问题为研究目标,以每两组间的差异mRNA,lncRNA,circRNA、miRNA为研究对象,采用韦恩分析方法,得到每两组中独有或共有的mRNA、lncRNA,circRNA、miRNA。 E50 VS E40和E60 VS E50差异mRNA/lncRNA韦恩图 Li Y et al., BioMed Research International. 2019 注:左图为E50 VS E40差异mRNA和E60 VS E50差异mRNA的韦恩分析结果;右图为E50 VS E40差异lncRNA和E60 VS E50差异lncRNA的韦恩分析结果。 2、 lncRNA/circRNA基因富集分析为了从庞杂的组学数据中发掘规律,研究lncRNA/circRNA的生物功能,NovelBio团队为研究者定制基因富集分析(Gene set enrichment analysis, GSEA),找到起关键作用的生物通路,进一步确定研究的lncRNA/circRNA与表型相关的生物学机制。 干预LncRNA GAS5的基因富集分析 Liu et al., Nat Commun, 2016 注:该图为LncRNA GAS5过表达和敲低后,hESCs的基因富集分析结果。其中,ES表示富集度得分,NES表示ES标化后的值,得分越高表示该基因类别与该干预呈正相关。 文献示例[1] Lei B, Zhou J, Xuan X, et al. Circular RNA expression profiles of peripheral blood mononuclear cells in hepatocellular carcinoma patients by sequence analysis. Cancer Med. 2019 Feb 4. (IF=3.202) [2] Li Y, Li GQ, Wang F, et al. Integrated Analysis of LncRNA-mRNA Coexpression in the Extracellular Matrix of Developing Deciduous Teeth in Miniature Pigs. BioMed Research International. 2019 Jan 23. (IF=2.583) [3] Yu Y, Zhang M, Liu J, et al. Long Non-coding RNA PVT1 Promotes Cell Proliferation and Migration by Silencing ANGPTL4 Expression in Cholangiocarcinoma. Mol Ther Nucleic Acids. 2018 Dec 7;13:503-513. (IF=5.66) [4] Qu S, Hao X, Song W, et al. Circular RNA circRHOT1 is upregulated and promotes cell proliferation and invasion in pancreatic cancer. Epigenomics. 2018 Nov 16;11(1):53-63. (IF=4.979) [5] Yu Y, Zhang M, Wang N, et al. Epigenetic silencing of tumor suppressor gene CDKN1A by oncogenic long non-coding RNA SNHG1 in cholangiocarcinoma. Cell Death Dis. 2018 Jul 3; 9(7):746-758. (IF=5.638) [6] Yin D, Lu X, Su J, et al. Long noncoding RNA AFAP1-AS1 predicts a poor prognosis and regulates non-small cell lung cancer cell proliferation by epigenetically repressing p21 expression. Mol Cancer. 2018 May 24;17(1):92. (IF=7.776) [7] Liang Ding,et al. A novel stromal lncRNA signature reprograms fibroblasts to promote the growth of oral squamous cell carcinoma via LncRNA-CAF/interleukin-33. Carcinogenesis. 2018 Mar 8;39(3):397-406. (IF=5.105) [8] Sun D,et al.LncRNA GAS5 inhibits microglial M2 polarization and exacerbates demyelination. EMBO Rep. 2017 Oct;18(10):1801-1816. (IF=8.568) [9] Lai, Z.Y. et al. Analysis of co-expression networks for circular RNAs and mRNAs reveals that circular RNAs hsa_circ_0047905, hsa_circ_0138960 and hascircRNA7690-15 are candidate oncogenes in gastric cancer. Cell Cycle. 2017 Oct 5:1-11. (IF=3.53) [10] Zhang E, et al. H3K27 acetylation activated-long non-coding RNA CCAT1 affects cell proliferation and migration by regulating SPRY4 and HOXB13 expression in esophageal squamous cell carcinoma. Nucleic Acids Res. 2017 Apr 7;45(6):3086-3101.. (IF=10.162) [11] Xu C, et al. Long non-coding rna gas5 control human embryonic stem cell self renewal by maintaining nodal signaling. Nat Commun. 2016 Nov 4;7:13287. (IF=12.124) [12] Zheng Q, et al. Circular RNA profiling reveals an abundant circHIPK3 that regulates cell growth by sponging multiple miRNAs. Nat Commun. 2016 Apr 6;7:11215. (IF=11.47) [13] Liu Q, et al. Circular RNA Related to the Chondrocyte ECM Regulates MMP13 Expression by Functioning as a MiR-136 ‘Sponge’ in Human Cartilage Degradation. Sci Rep. 2016 Mar 2;6:22572. (IF=5.578) 上一篇Small RNA测序下一篇外显子测序 |